使出現在物質的温度,能觀察的熱=顯熱,物質的状態變化,但是不能觀察的熱=潛熱。
顕熱+潜熱=全熱
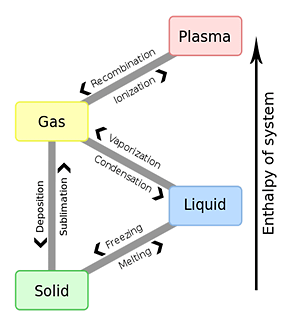
物質之三態的相転移
※使氣體變成液體時候的凝結熱在蒸發熱和絕對值一樣,并且符號變得相反。
※蒸發熱正表現被物質吸收的熱,正式,因為凝結熱是物質放出的熱所以取得負的值。
2-9-1.潜熱
潛熱在物質在氣體從液體或者液體從固體做相位轉變的時候,是被需要的熱能的總量。
在潛熱,有伴隨融化的熔化熱和伴隨蒸發的蒸發熱(氣化熱)。
約瑟夫·布萊克引入了潛熱的概念。
約瑟夫·布萊克不冰在融化的時候在1761年更換温度而表示吸收熱,和熱素 (caloric) 冰的粒子連接起來的話想了。
另外,從差別在同容積的水和水銀的温度上升有的事實,產生熱容量以及比熱的概念,做貢獻了為熱學的發展。
約瑟夫·布萊克(Joseph Black,1728年4月16日-1799年11月10日)是蘇格蘭的物理學家,化學家。
2-9-1-1.融解熱
融解熱是在一定的量的物質對液體從固體做相位轉變的時候需要的熱量。
學分是J/g或者J/mol,并且冰的熔化熱是333.5J/g。
2-9-1-2.蒸發熱(氣化熱)
蒸發是液體状態的原子或者分子得到足夠的能量,是氣體的状態的過程。
始自於液體的蒸發用沸點以下的温度發生,在在飽和蒸氣壓成為之前蒸氣壓繼續,在那裡到達液相平衡,結束。
液體的温度達到沸點的話氣化(沸騰)也由液體内部產生。
在這裡,液體在蒸發之際從周圍需要蒸發熱(氣化熱)。
有戰勝液體的表面張力(分子間力)的熱運動能量的分子能蒸發。
換句話說蒸發的分子有超過關於對液體表面的附著的工作函數的力學上的能量。
因而到液體的温度高到表面張力低的程度的程度蒸發更早早進行。
幹預蒸發,那個系統的熵正增大,能量的流入被隨著相位改變需要。
為了讓繼續蒸發,加速利用加熱器的熱能的繼續的供給是必要的。
比方說氦的蒸發熱和0.0845 kJ/mol極端低的是在氦原子之間起作用的fanderuwarusu力非常小。
為氫鍵對反對在水分子之間起作用蒸發熱是40.8 kJ/mol和大把水加熱到從0℃到100℃時候的熱容量(7.53 kJ/mol)的大約5倍的值。
在沸點做蒸發熱的測量,但是被在298K(25度)的值修正的值普通被使用(因為不在測量誤差之上所以能無視出自補正的變化)。
學分,kcal/mol(毎個千卡莫爾)被使用,但是與kJ/mol(毎個千焦耳莫爾)的書寫方式最近是主流。
然而,在在分子間力的測量利用蒸發熱的時候需要警告。
分子間力,為也對氣相的物質起作用,小的值被測量比實際也。
為用共價結合的状態存在著金屬的氣體特別必須在分子間力的測量測量原子化熱。
2-9-2.顕熱
顯熱不更換物質的状態(相)而是為使衹温度變化耗費的熱量。
比方說把20度的水放入水壺,放在火上燒。
熱對水壺傳達,温度從火上升到從20℃到60℃了。
這時水得到的熱是顯熱。
學術上的定義
在”系統的温度同時和内部能量的增加一起在正由許多分子構成的系統上升的時候,和顯熱”說作為這個微視的力學能量